一、依托背景
目前世界上已知的罕见病种类约有7000余种,受影响人数超过3亿。但罕见病的诊疗技术却远远落后于常见疾病,尤其是具有特异性治疗作用的药物仅400-500种,即只有约7%的患者有药可医,而这其中在我国上市的还不足20%,且绝大多数为进口药物,费用极其高昂,多数患者难以承受。
为贯彻落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,加强我国罕见病管理,提高罕见病诊疗水平,推动罕见病药物研发,维护罕见病患者健康权益,国家卫生健康委员会、科技部、工信部、CFDA以及国家中医药管理局等5部门联合制定了《第一批罕见病目录》,并于2018年05月11日正式发布,以供各医药领域机构在工作中参考使用。
二、相关政策及影响
根据国务院于2017年10月08日发布的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》以及国家在2015-2017年间陆续出台的一系列鼓励药品医疗器械创新的政策(第52号~55号公告)内容,均支持推动罕见病药物研发。尤其第55号公告明确提出“申请人在提交药品上市申请时,可同时提交实验数据申请保护。对既属于创新药又属于罕见病用药、儿童专用药,给予10年的数据保护期;属于改良型新药的罕见病用药、儿童专用药,给予3年数据保护期。”同时,国家卫计委也在2015年12月24日成立了“国家卫生计生委罕见病诊疗与保障专家委员会”,专门用于研究提出符合我国国情的罕见病定义和病种范围,组织制定罕见病防治有关技术规范和临床路径,对罕见病的预防、筛查、诊疗、用药、康复及保障等工作提出建议。 特别值得一提是,上海市在2016年就率先出台了《上海市主要罕见病名录(2016年版)》,成为国内第一个具有官方性质的罕见病名录,共收录了56种罕见疾病。
为了加大对罕见病药物研发方面的重视,我国对相关药物的研发推进做了很多政策上的鼓励与支持,具体表现在加快罕见病用药进口审批速度,目前已有超过130种罕见病药物在国内获得批准;同时加速相关孤儿药的审评审批,降低企业的研发成本,从而激发相关药企对罕见病药物研发的积极性,让更多企业加入到罕见病药物的研发中来。据业内专家预测,随着官方定义的首批罕见病目录的出台,未来减免临床及药品附带条件上市等政策也会相继展开,为罕见病患者带来更多福音,我国罕见病领域即将进入发展的黄金期。
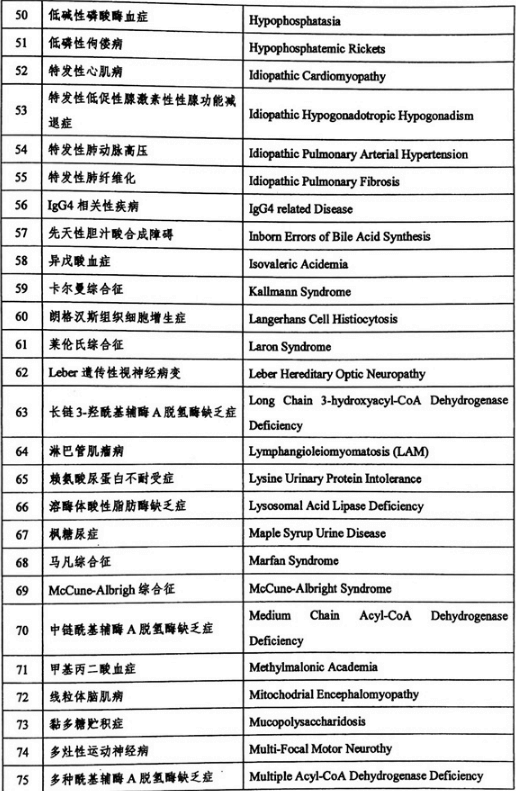
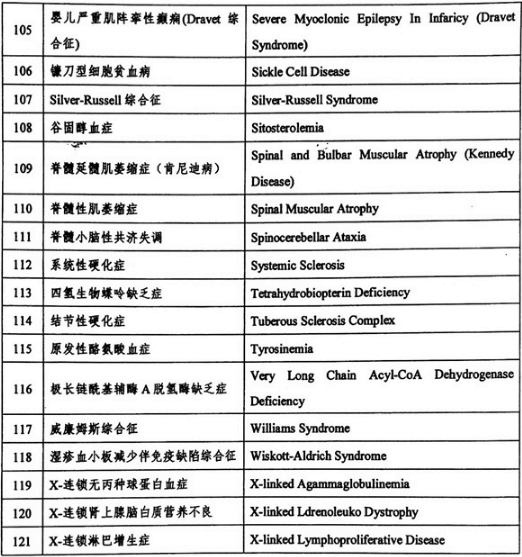
三、《第一批罕见病目录》发布的121个病种相关情况
据业内机构统计,在《第一批罕见病目录》发布的121个病种中,仅有44个病种有相关药物在全球上市,其中在中国上市的则不到一半,远远无法满足此大类疾病治疗药物的市场需求。而从整体注册情况来看,早发性帕金森病等疾病的国内外研发比较成熟,我国已有多个品种上市;血友病等部分疾病的药品已在国内上市,还有部分在研发中;其余领域国内的研发水平尚低于国外,许多品种还未开展研发工作,处于相对空白阶段。
附表:《第一批罕见病目录》发布的121个病种名单